
论NAD的强大作用
NAD的功能非常强大,作为氧化还原反应的关键辅酶和NAD依赖性酶的共底物,NAD及其代谢物是很多生理过程的调节枢纽,包括氧化还原稳态、基因组稳定性、基因表达、RNA加工、能量代谢、免疫和炎症以及生物钟。

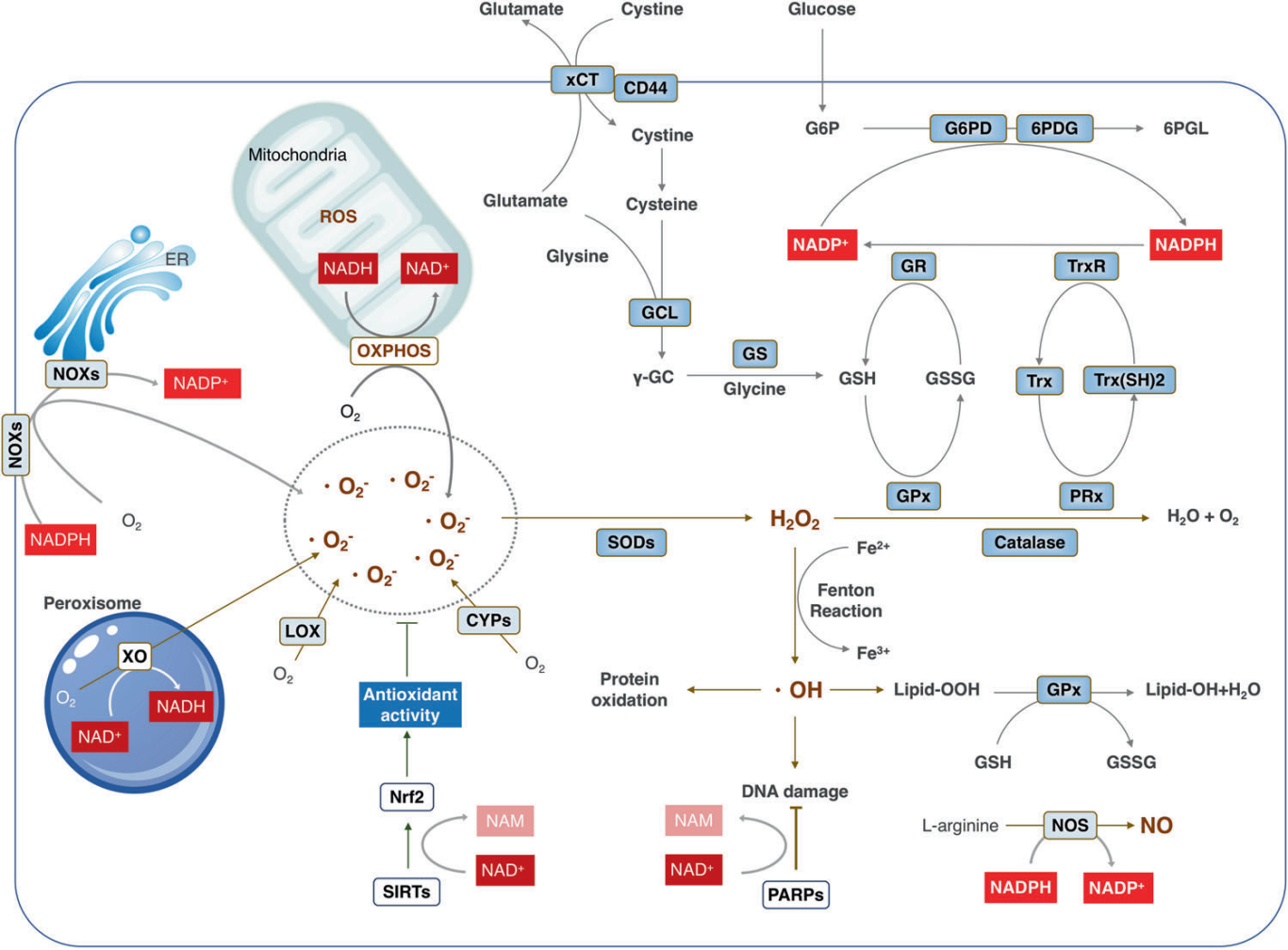
ROS可以由线粒体中的代谢反应产生,比如氧化磷酸化(OXPHOS),也可以由一系列胞质酶产生,在此过程中都需要NADH/NADPH作为电子供体。NAD可以通过增加GSH水平和抗氧化酶的活性来增强抗氧化能力。为了抵消氧化剂的有害影响,细胞可以提高还原当量,如NADPH的产生。此外,消耗NAD的酶,如SIRT3,还可以通过调节产生ROS的酶和根除ROS的抗氧化因子的活性来操纵细胞氧化还原状态。所以说,NAD代谢组,是决定生物氧化还原状态的控制开关[1-3]。
内源性氧化损伤以及外源性损伤,如辐射、环境毒素、致癌物等,都会造成DNA损伤,DNA损伤以及随后出现的基因组不稳定是导致衰老和肿瘤发生的主要驱动力。
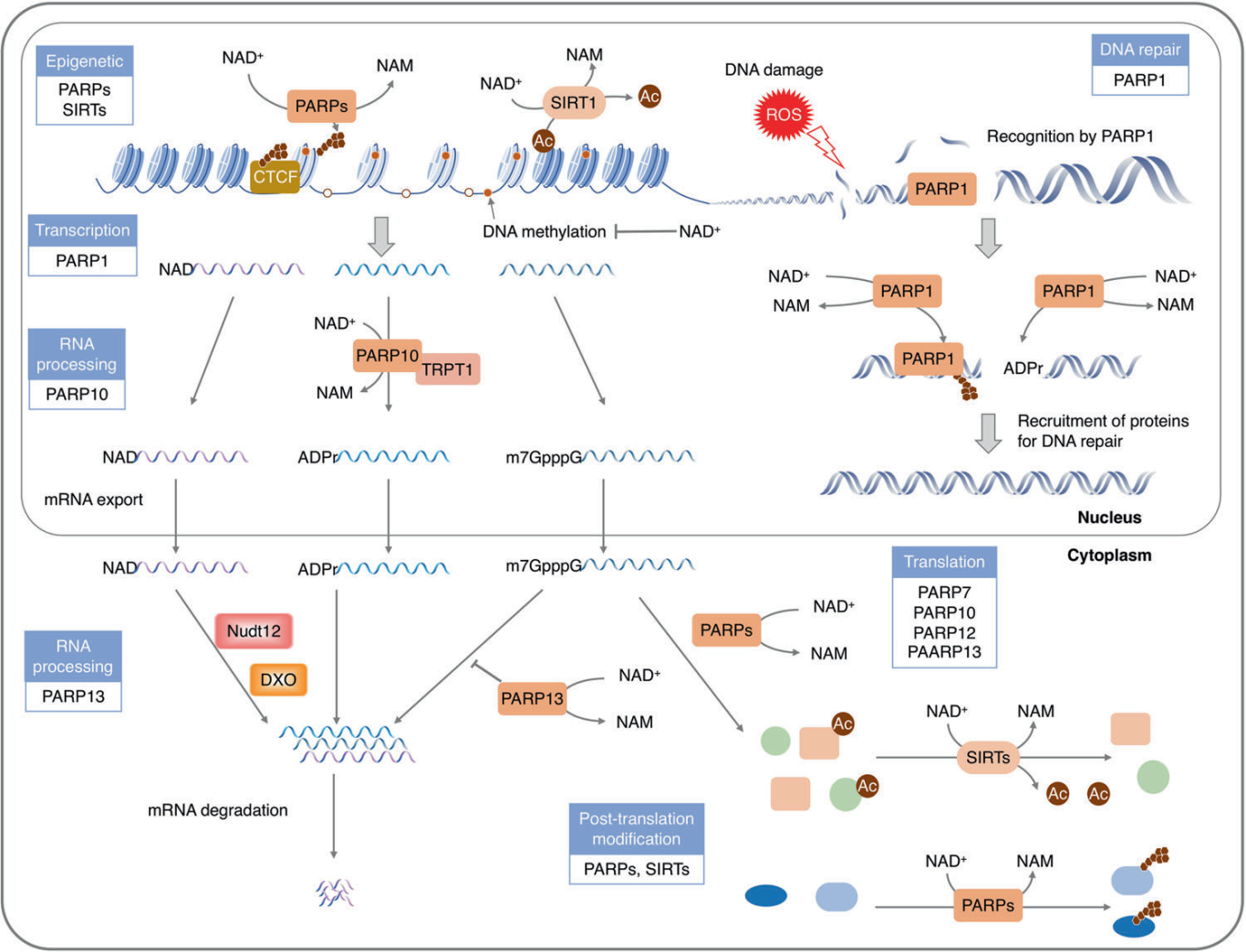
为了维持基因组的稳定性,细胞进化出一种复杂的微调机制来检测和修复DNA损伤,称之为DNA损伤反应(DDR)[4-7]。PARPs和sirtuins是多种DNA修复途径的关键调节因子,NAD是它们的共底物。NAD的缺乏会导致DNA损伤反应受损,基因组不稳定性增加,表明基因组稳定性与NAD代谢之间存在相互作用[8-9]。
NAD+作为一种辅酶,在糖酵解、TCA循环、OXPHOS、FAO和乙醇代谢等能量代谢途径中发挥着关键作用[10]。
NAD+通过促进GAPDH和乳酸脱氢酶(LDH)催化的酶促反应来促进糖酵解,后者以NAD+作为辅酶[11]。胞质丙酮酸也可以通过LDH转化为乳酸,同时NADH被氧化为NAD+[12],这一过程有助于维持NAD+的胞质水平,从而有助于糖酵解的连续性。当转运到线粒体时,糖酵解最终产物丙酮酸通过PDH复合物脱羧产生乙酰辅酶A,同时将NAD+还原为NADH[13]。
在TCA循环中,NAD+作为三种限速酶α-酮戊二酸脱氢酶(KGDH)、异柠檬酸脱氢酶3(IDH3)和苹果酸脱氢酶(MDH2)的辅酶,生成NADH。因此,在有氧条件下,三羧酸循环可以利用线粒体中的一个丙酮酸分子将4个NAD+分子转化为NADH。作为电子供体,TCA循环中产生的NADH在OXPHOS合成ATP中起着至关重要的作用[14]。
NAD+代谢紊乱导致细胞氧化还原环境失衡,从而诱导不同的反应,如抗氧化防御、细胞信号传导、免疫反应等过程。NAD+或NADPH水平决定了ROS在感染中的作用,要么保护微生物免受入侵,要么在由此导致的过度炎症过程中造成组织损伤。
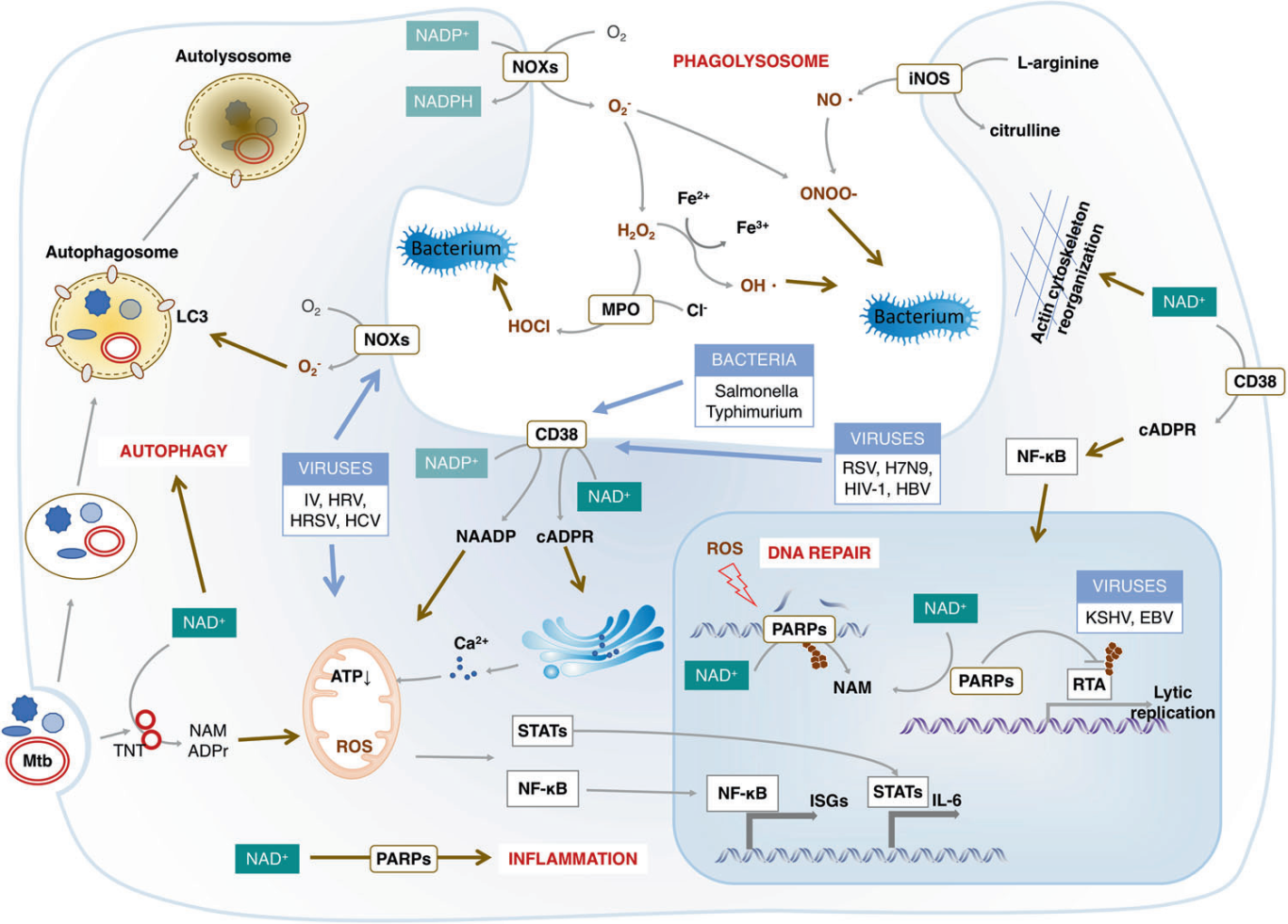
微生物感染会导致氧化应激,对微生物和宿主细胞都有关键影响。NOXs产生的ROS依赖于NADPH,被称为呼吸爆发,这是一种强大的抗菌武器,也是对抗细菌和真菌感染的先天免疫防御的主要组成部分。同时,氧化应激导致宿主DNA损伤,通过升高的PARPs来增加NAD+的消耗。细胞内的NAD+也可以通过激活CD38来降低,这是炎症对抗感染所必需的。
研究发现,A组链球菌(GAS)感染后,NAD+浓度和NAD+/NADH比值显著升高,添加NAM显著提高了细胞内NAD+含量,促进了内皮细胞自噬体酸化和GAS清除[15]。因此,NAD (P)+/NAD (P)H通过促进ROS的产生、促炎反应和抗感染自噬来发挥杀菌活性,NAD+的缺乏可能会导致机体通过自噬、先天免疫和炎症反应清除微生物的能力受损][16-17]。
生物体已经发展了内部时钟作为一种计时机制,使生物过程与外源环境和内源因素协同作用。NAD+通过表观遗传机制作为昼夜节律转录的代谢驱动因素,将环境刺激产生的信号转导到生物钟。
NAD+通过NAD(P)+/NAD(P)H比值调节核心振荡器的DNA结合活性。时钟对细胞内NAD+水平的昼夜节律控制归因于NAMPT的振荡表达,NAMPT是一种以24小时节律挽救NAD+的限速酶[18-19]。反过来,NAD+的振荡通过生物钟协调转录和行为。老年小鼠NAD+的减少抑制了昼夜节律转录,而通过NR将NAD+补充到年轻水平可以挽救这一转录[20]。
[1] Le Belle, J. E. et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell 8, 59–71 (2011).
[2] Tan, B. L., Norhaizan, M. E., Liew, W. P. & Sulaiman Rahman, H. Antioxidant and oxidative stress: a mutual interplay in age-related diseases. Front. Pharmacol. 9,1162 (2018).
[3] Bedard, K. & Krause, K. H. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology. Physiol. Rev. 87, 245–313 (2007).
[4] Kim, H. S. et al. SIRT3 is a mitochondria-localized tumor suppressor required for maintenance of mitochondrial integrity and metabolism during stress. Cancer Cell 17, 41–52 (2010).
[5] Niedernhofer, L. J. et al. Nuclear genomic instability and aging. Annu. Rev. Biochem. 87, 295–322 (2018).
[6] Sancar, A., Lindsey-Boltz, L. A., Unsal-Kaçmaz, K. & Linn, S. Molecular mechanisms
of mammalian DNA repair and the DNA damage checkpoints. Annu. Rev. Biochem. 73, 39–85(2004).
[7] Lagunas-Rangel, F. A. Current role of mammalian sirtuins in DNA repair. DNA Repair 80, 85–92 (2019).
[8] Fania, L. et al. Role of nicotinamide in genomic stability and skin cancer chemoprevention. Int. J. Mol. Sci. 20, 5946 (2019).
[9] Hurtado-Bagès, S., Knobloch, G., Ladurner, A. G. & Buschbeck, M. The taming of PARP1 and its impact on NAD(+) metabolism. Mol. Metab. 38, 100950 (2020)
[10] Canto, C., Menzies, K. J. & Auwerx, J. NAD(+) metabolism and the control of energy homeostasis: a balancing act between mitochondria and the nucleus.
[11] Tan, B. et al. Inhibition of nicotinamide phosphoribosyltransferase (NAMPT), an enzyme essential for NAD+ biosynthesis, leads to altered carbohydrate metabolism in cancer cells. J. Biol. Chem. 290, 15812–15824 (2015).
[12] Xiao, W., Wang, R. S., Handy, D. E. & Loscalzo, J. NAD(H) and NADP(H) redox couples and cellular energy metabolism. Antioxid. Redox Signal. 28, 251–272 (2018).
[13] Lunt, S. Y. & Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annu. Rev. Cell Dev. Biol. 27, 441–464 (2011).
[14] Yang, Y. & Sauve, A. A. NAD(+) metabolism: bioenergetics, signaling and manipulation for therapy. Biochim. Biophys. Acta 1864, 1787–1800 (2016).
[15] Pajuelo, D., Gonzalez-Juarbe, N. & Niederweis, M. NAD hydrolysis by the tuberculosis necrotizing toxin induces lethal oxidative stress in macrophages.Cell. Microbiol. 22, e13115 (2020).
[16] Najibi, M., Moreau, J. A., Honwad, H. H. & Irazoqui, J. E. A novel PHOX/CD38/MCOLN1/TFEB axis important for macrophage activation during bacterial phagocytosis. bioRxiv 669325 (2019).
[17] Matalonga, J. et al. The nuclear receptor LXR limits bacterial infection of host macrophages through a mechanism that impacts cellular NAD metabolism. Cell Rep. 18, 1241–1255 (2017).
[18] Ramsey, K. M. et al. Circadian clock feedback cycle through NAMPT-mediated NAD+ biosynthesis. Science 324, 651–654 (2009).
[19] Luna, A., McFadden, G. B., Aladjem, M. I. & Kohn, K. W. Predicted role of NAD utilization in the control of circadian rhythms during DNA damage response.PLoS Computat. Biol. 11, e1004144 (2015).
[20] Levine, D. C. et al. NAD(+) controls circadian reprogramming through PER2 nuclear translocation to counter aging. Mol. Cell 78, 835–849.e837 (2020).

