师兄,我最近做了次逆转录平行对比实验,发现有些产品CT值更小,是不是说明这些产品的性能更好?

别着急啊,你的实验数据可靠吗
啊!这个实验不是很简单吗,这要怎么确认呀?
我来问问你,逆转录之后做定量的引物设计有跨内含子吗?
没有呢......
那逆转录的时候你有没有做基因组清除这个步骤呢?
嗯嗯,做了,我都是按照说明书来操作的。
你确定这个过程gDNA清除干净了吗?
这个我不太确定哎......这步对实验结果影响很大吗?
那当然啦!
小伙伴们是否遇到过类似情况呢?不要担心,我们这就为大家解惑。
1. RNA 中残留的 gDNA 会导致定量结果不准确
通常,我们提取到的 RNA 会混有 gDNA (基因组 DNA),所以逆转录后,cDNA 产物中也会混有 gDNA。在 qPCR(定量PCR) 反应时,cDNA 和 gDNA 可能会被同时扩增,定量仪器无法区分荧光信号是来自 cDNA 还是 gDNA,因此结果可能会存在偏差。特别是低表达量的基因,本身的扩增信号低,CT 值大,更加容易受到 gDNA 污染的影响。为了避免这种情况发生,可采取如下两种措施:
gDNA 具有内含子和外显子,跨内含子设计引物可以避免基因组 DNA 的扩增,但是,此种方法不适合具有单个外显子的基因,或者不具有内含子的物种以及基因组序列没被解析的物种等;
如果大家在实验前不知道具体信息或觉得设计跨内含子引物比较复杂,这时可考虑使用DNase I(脱氧核糖核酸酶I)处理 gDNA,或者使用能去除 gDNA 的逆转录试剂进行逆转录反应。
2. RNA 中残留的 gDNA 容易发生非特异性扩增
cDNA 中残留 gDNA,下游实验做 qPCR 或 PCR 时,双链 DNA(gDNA)在高温下变性发生解链,与引物结合,消耗掉部分 DNA 聚合酶和引物,容易出现非特异性扩增,无法获得更准确和有意义的实验结果!
为了验证基因组残留是否会对 qPCR 结果造成严重影响,我们做了对应实验,结果如下:
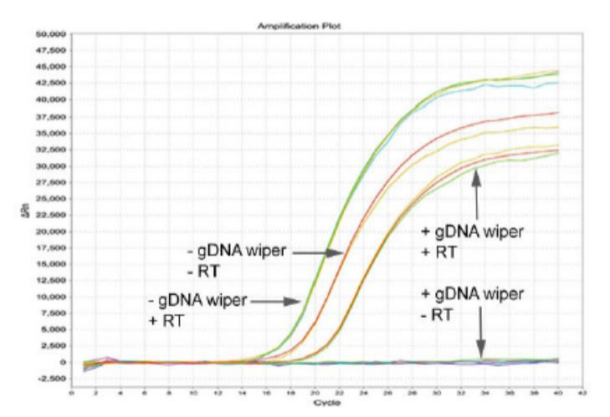
图1.基因组清除对荧光定量PCR结果的影响
从图1中能看出+gDNA wiper(gDNA 清除剂)+RT(逆转录)与-gDNA wiper +RT 比对时,后者CT值偏小。而-gDNA wiper–RT 理论上没有模板cDNA就无法扩增,目前出现扩增曲线,说明此时扩增的是 gDNA。因此基因组清除不干净似乎会使产品看起来性能更好,但这个结果是不准确的,数据分析也就大打折扣甚至失去意义!
我们要怎么判断基因组清除效果呢?我们为大家提供了两种方法:
(1)逆转录实验时加入对照-NRT(NO RT control,加入除逆转录酶外其他组分),实验结果如图 2 所示:
图2.A公司逆转录产品扩增曲线及熔解曲线(左图);Vazyme 逆转录产品扩增曲线及熔解曲线(右图)。
从图2中可以看出,在NRT实验中,右图NRT没有扩增曲线,说明 cDNA中没有gDNA残留,如果NRT有明显扩增且发现两者熔解曲线(NRT与目的基因)重合,说明有gDNA残留;
(2)逆转录时做基因组清除效率比对实验,以基因组 DNA 为模板,清除gDNA与不清除gDNA同时逆转录后做qPCR,根据CT值计算清除效率。具体清除效率计算公式为 1-1/2△CT(△CT = CT清除 - CT不清除),实验结果如图 3 所示:
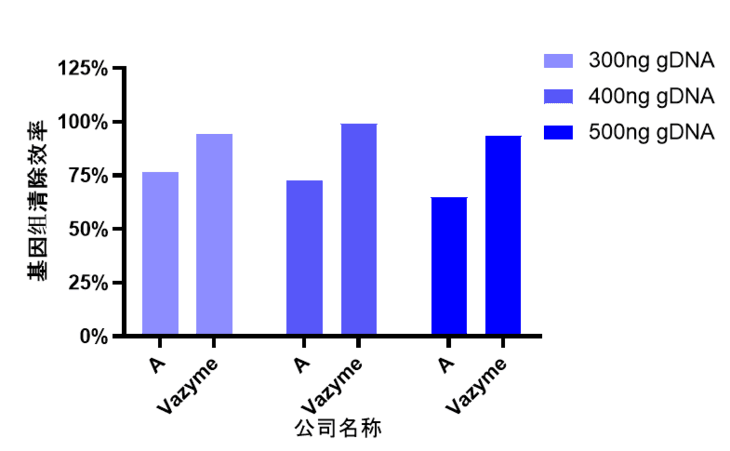
图3.不同gDNA投入量下的逆转录产品基因组清除效率比对
Vazyme 对应产品基因组的清除效率更高,说明 Vazyme 对应产品gDNA清除效果更好。如果基因组清除效率不高,会导致qPCR 结果CT值偏小,最后使得实验数据不真实。
了解之后,发现基因组残留会导致非特异性扩增,从而使我们高估目的基因的真实表达量。因此,大家之后在做逆转录实验的时候也要考虑基因组清除效果对 CT 值的影响哦!
诺唯赞基因组清除逆转录试剂火爆订购中!